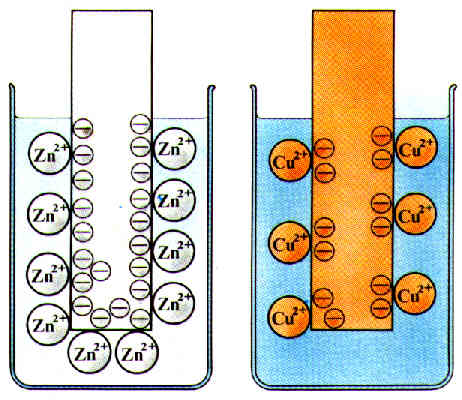
Dieses Gleichgewicht bildet sich beim Eintauchen der Metalle in deren jeweiligen Lösungen an der Metalloberfläche aus. Aus dem Metallgitter gehen Metall-Ionen in die Lösung, und Elektronen bleiben im Metall zurück. Das dadurch negativ aufgeladene Metall zieht die in der Lösung gegangenen positiv geladenen Metall-Ionen wiederum an. Es bildet sich eine elektrische Doppelschicht aus.

Da die Tendenz der Zink-Atome, unter Elektronenabgabe Ionen zu bilden, größer ist als die der Kupfer-Atome, herrscht an der Zink-Elektrode ein Elektronenüberschuß gegenüber der Kupfer-Elektrode. Die Zink-Elektrode bildet den Minus-Pol, die Kupfer-Elektrode den Plus-Pol der galvanischen Zelle. Die Zink-Halbzelle, in der die Elektronenabgabe oder Oxidation erfolgt, ist die Donator-Halbzelle, die Kupfer-Halbzelle stellt die Akzeptorhalbzelle dar.
Während des Betriebs der Zelle nimmt allmählich die Masse der Zink-Elektrode ab, und die der Kupfer-Elektrode zu. Entsprechend sinkt die Konzentration der Kupfer-Ionen in der Kupfer-Halbzelle, gleichzeitigt steigt die Konzentration der Zink-Ionen in der Zinkhalbzelle. Infolge einer Wanderung der Sulfat-Ionen von der Kupfer-Halbzelle durch die semipermeable Membran in die Zink-Halbzelle und der Zink-Ionen von der zink-Halbzelle zur Kupfer-Halbzelle bleibt in den Lösungen beider Halbzellen die Ladungsneutralität gewährleistet.

Das Daniell-Element kann als Spanungs- uhnd Stromquelle dienen. Im Gegensatz zur Spannung (sie liegt bei 1,1 V) ist die Stromstärke, je nach Versuchsanordung, sehr unterschiedlich. Sie ist z.B. von der Oberfläche und dem Abstand der Elektroden, sowie der der Temperatur und dem Druck, abhängig.
Auch die Spannung des Daniell-Element kann verändert werden. Sie ist von der Konzentration der Lösungen abhängig. Im Normalfall geht man von einer Konzentration von 1 mol/l aus. Wird die Konzentration verändert, muß man das Potential der beiden Halbzellen, und damit auch die Spannung des gesammten Elements. Dieses kann man wie folgt errechnen:
EMK = U = E(Cu) - E(Zn)
E(Cu) = E°(Cu) + 0,059V /z * lg{c(Cu²+)}
E(Zn) = E°(Zn) + 0,059V /z * lg{c(Zn²+)}
Setzt man die entsprechenden Werte ein, so gelangt man zu der Spannung, die eine galvanische Zelle besitzt. E° ist das Standard-Elektroden-Potenzial des Metalls, welches man aus einer Tabelle entnehmen kann. z entspricht der Anzahl der Elektronen, die freigegeben werden. Die Konzentration wird angegeben oder muß errechnet werden.
Die in der galvanischen Zelle ablaufende
Zellreaktion ist eine Umkehrung der Elektrolyse-Reaktion.